
Periyodik tablo ya da periyodik sistem, günümüzde elementleri ve özelliklerini kolayca kavrayabilmek için kullandığımız sistemdir.
18-19. yüzyıllar arasında yapılan kimya çalışmaları sonucunda, doğada birbirinden farklı özelliklere sahip farklı elementlerin varlığı keşfedildi. Keşfedilen elementler ve bilinen özellik sayısı arttıkça bunları sınıflandırma ihtiyacı duyuldu. Bu sınıflandırma çalışmaları için ilk girişimi 1789’da A. Lavoisier, elementleri gazlar, ametaller ve toprak elementleri olarak sınıflandırarak yaptı. Ancak sonraki yıllarda elementlerin özelliklerini keşfetmek ve farklı şekilde gruplandırmak için başka girişimler de oldu ve günümüzde kullandığımız ve yukarıdaki fotoğrafta gördüğünüz tablonun temelleri atıldı.
Periyodik Tablonun Tarihsel Gelişimi
Dmitri Mendeleyev ve Periyodik Sistem
 19. yüzyılda Dmitri Ivanovich Mendeleyev (Dimitri İvanoviç Mendelev), 1860 yılına kadar bilinen elementlerin fiziksel ve kimyasal özelliklerini farklı kartlara yazarak elementleri artan atom ağırlığına göre sıraladı. Bu sıralamada elementlerin özelliklerinin belirli aralıklarla başka elementlerde de gözlemlendiğini fark etti ve artan atom ağırlığı düzenini bozmadan, aynı özellikteki elementleri alt alta getirerek bir çizelge oluşturdu. Oluşturduğu çizelgede bilinmeyen elementlerin olduğunu düşündü ve daha sonra keşfedilmesini umarak yerlerini boş bıraktı.
19. yüzyılda Dmitri Ivanovich Mendeleyev (Dimitri İvanoviç Mendelev), 1860 yılına kadar bilinen elementlerin fiziksel ve kimyasal özelliklerini farklı kartlara yazarak elementleri artan atom ağırlığına göre sıraladı. Bu sıralamada elementlerin özelliklerinin belirli aralıklarla başka elementlerde de gözlemlendiğini fark etti ve artan atom ağırlığı düzenini bozmadan, aynı özellikteki elementleri alt alta getirerek bir çizelge oluşturdu. Oluşturduğu çizelgede bilinmeyen elementlerin olduğunu düşündü ve daha sonra keşfedilmesini umarak yerlerini boş bıraktı.
Tabloda bıraktığı boşlukların, keşfedilmeyi bekleyen elementlerin özelliklerini tahmin etmede ne kadar yararlı olabileceğini, bazı elementlerin özelliklerini gerçeğine yakın tahmin ederek göstermiştir.
Örneğin; 1872 yılında Mendeleyev ilk kez çizelgeyi yayınladığında galyum, skandiyum ve germanyum elementleri henüz keşfedilmemişti. Mendeleyev bu elementlerin varlığı ve özelliklerini, çizelge düzenlendiğinde bıraktığı boşluklarda doğru bir biçimde öngörmüştür. Mendeleyev’in oluşturduğu çizelge zamanla modern periyodik sisteme dönüşmüştü. Bu çizelge elementlerin periyodik özelliklerini göstermesine rağmen, elementlerin özelliklerinin periyodik olarak neden tekrar ettiği ancak 20. yüzyıl da bilim insanlarının keşifleri sonucu açıklanabilmiştir.
Moseley ve Modern Periyodik Sistem
 Ünlü İngiliz Fizikçi Henry Moseley, her elementin atom numarasının aynı zamanda nötr atomdaki elektronların sayısına eşit olduğunu keşfetti. Moseley, atom numaraları 13 ile 79 arasında olan 38 elementin farklı enerjilerde yaydığı ışımalar üzerinde çalışmalar yaptı. Işınların enerjileri ile elementlerin atom numaraları arasında bir ilişki bulunduğunu ispatlayarak elementlerin atom numaralarını doğru tahmin etti.
Ünlü İngiliz Fizikçi Henry Moseley, her elementin atom numarasının aynı zamanda nötr atomdaki elektronların sayısına eşit olduğunu keşfetti. Moseley, atom numaraları 13 ile 79 arasında olan 38 elementin farklı enerjilerde yaydığı ışımalar üzerinde çalışmalar yaptı. Işınların enerjileri ile elementlerin atom numaraları arasında bir ilişki bulunduğunu ispatlayarak elementlerin atom numaralarını doğru tahmin etti.
Moseley’in atom numaraları ile ilgili elde ettiği sonuçlara göre atom numaraları bir elementten diğerine geçişte bir tam sayı artıyordu. Bu keşif ile birlikte elementleri artan atom numaralarına göre düzenledi ve böylece Moseley’in elementler tablosu oluştu ve günümüzde halen bu tablo kullanılmaktadır.
Moseley, tabloda keşfedilmeyen atomlara da yer verdi. 92 elementten oluşan periyodik cetvelinde keşfedilmeyen elementler için boşluklar (43, 61, 85, 87 ve 91 atom numaralı elementler) bıraktı. Her bir elementin proton sayısı yalnız o elemente özgü olduğu için Moseley keşfedilmemiş olan atomları öngördü. Günümüzde kullanılan modern periyodik sistem Moseley’in yaptığı sıralamaya dayanır. Bir çok yeni elementin keşfedilmesiyle, günümüz modern periyodik sisteminde Moseley’in bıraktığı boşluklar doldurulmuş yeni elementlerin bir çoğu laboratuvar ortamında yapay olarak elde edilmiştir.
Periyodik Sistem/Tablo Özellikleri
Gruplar ve periyotlar
Periyodik sistemde elementler, satır ve sütunlara göre sıralanmaktadır. Satırlar periyot, sütunlar ise grup olarak adlandırılır. Atom numarası bir satır boyunca soldan sağa ve sütun boyunca yukarıdan aşağıda doğru artmaktadır.

Periyodik sistemde gruplar A grubu ve B grubu olmak üzere iki tanedir. Sistemde 8 tane A, 10 tane de B grubu ve 7 tane periyot bulunur. Elementlerin periyodik sistemdeki yerleri grup ve periyot belirtilerek bulunur/söylenir. Elementlerin yer aldığı grup ve periyot atomun katman-elektron dağılımı ile ilişkilidir. Örneğin; bir element atomunun son elektron katmanında 5 elektron bulunuyorsa o element 5A grubunda, 2 elektron bulunuyorsa 2A grubunda yer alır. Aşağıdaki tabloda ilk 20 element atomunun katman-elektron dağılımı ve bu dağılıma göre grup numarası gösterilmiştir:
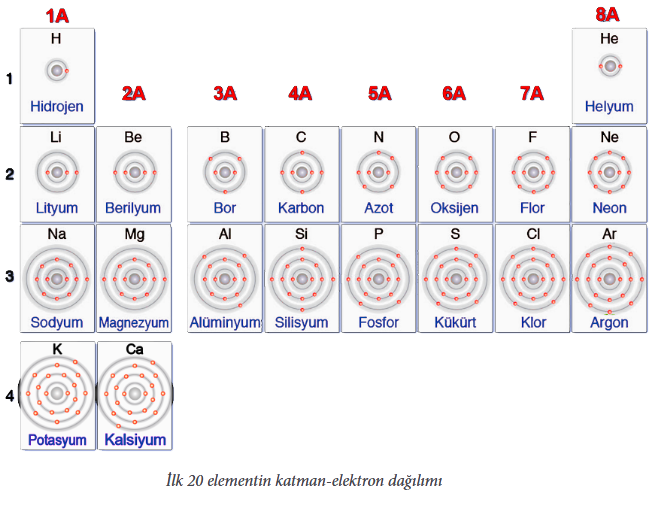
Görselden de anlaşılacağı gibi aynı grupta yer alan element atomunun son katmanında yer alan elektron sayısı aynıdır. Ancak gruptaki her element atomunun katman sayısı farklıdır ve grupta yukarıdan aşağıya doğru inildikçe katman sayısı artar. Örneğin; 1A grubu elementlerinden hidrojen (H) elementi “1” katman ve “1” elektrona; lityum (Li) elementi “2” katman ve son katmanında “1” elektrona; sodyum (Na) elementi ise “3”katman ve yine son katmanında “1” elektrona sahiptir.
Aynı grup elementleri katman sayısı artsa da en dış katmanlar aynı elektron sayısı ve düzenine sahiptir. Değerlik eleketonlar elementin kimyasal özelliklerini belirirler ve bu nedenle aynı gruptaki elementlerin fiziksel ve kimyasal bir çok özelliği benzerlik gösterir. Bir elementin hangi periyotta bulunduğu ise element atomunun katman-elektron dağılımıyla ilgilidir. Element atomunun katman sayısı o elementin periyot numarasını verir.
Örneğin; bir element atomu tek katmanlıysa o element 1. periyotta, 2 katmanı varsa 2. periyotta bulunur. Aşağıdaki görseli incelerseniz Magnezyum (Mg) element atomunun 3 katmanı olduğunu ve 3. periyotta yer aldığını görebilirsiniz.
3. Periyot Elementleri

Bir element atomunun en fazla yedi katmanı bulunabilir ve bu sebeple periyodik sistemde toplam yedi periyot bulunur. Bir elementin yalnızca periyodik sistemdeki yerine bakarak fiziksel ve kimyasal özellikleri tahmin edilebilir. Periyodik sistem, elementlerin kimyasal aktifliği, elektrik iletme olasılığı, sertliği ve yumuşaklığı gibi özelliklerin kısa yoldan anlaşılmasını sağlar. Belirli bir elementle ilgili hiçbir şey bilinmese de sistemdeki konum ve tanıdık olan diğer elementler ile olan grup ilişkisiyle tahminler yapılabilir.
Bir element atomunun en fazla yedi katmanı olabileceğinden, periyodik sistemde de toplam yedi periyot bulunur. Bir elementin yalnızca periyodik sistemdeki yerine bakarak, özellikleri tahmin edilebilir.
Örneğin; osmiyum elementi hakkında hiçbir bilginiz olmadığını farz edelim. Osmiyum elementinin periyodik sistemdeki konumuna bakıldığında demir ile aynı grupta yer aldığı görülür ve demirin yoğun, sert bir metal olduğunu bilinmektedir. Buradan Osmiyumun da yoğun ve sert bir metal olduğu tahmin edilebilir.
Periyodik Sistemde Sınıflandırma
Periyodik sistemde elementler genel olarak; metaller, yarı metaller, ametaller ve soygazlar olarak sınıflandırılmaktadır. Bu elementlerin çoğu metaldir ve periyodik sistemin solunda yer alırlar. Periyodik sistemin sağ tarafında ise ametal olmayan elementler yer alır. Ametaller ise hem metallerin hem de ametallerin bazı özelliklerine sahip yarı metallerdir. 8A grubunda soygazlar yer alır. Aynı grupta yer alan elementlerin benzer özellik göstermesi gibi aynı sınıfta yer alan elementler de benzer fiziksel ve kimyasal özellik gösterir.
Metaller

A grubunda bulunan elementlerin bir kısmı ile B grubu elementlerini içerir. Yukarıdaki tabloya tekrar bakılırsa metal elementler görülecektir. Metallerin bir çok özelliği benzerdir. Metaller;
- Oda sıcaklığında (cıva hariç) katıdırlar.
- Genellikle parlaktırlar.
- Isı ve elektriği iyi iletirler.
- Katı hâlde dövülerek, erimiş (sıvı) hâlde kalıplara dökülerek şekil verilebilir.
- Kimyasal tepkimelerinde ametallere elektron vererek artı (+) yüklü iyon oluştururlar.
- Kendi aralarında alaşım oluştururlar.
Ametaller
Periyodik sistemin sağ tarafında yer alırlar. Ametaller;
- Genellikle zayıf ısı ve elektrik iletkenliğine sahiptir.
- Oda koşullarında ametallerin bazıları katı, bazıları sıvı, bazıları da gaz hâlde bulunur.
Örneğin; oda sıcaklığında oksijen, azot gaz hâlde; brom sıvı, iyot ise katı hâldedir. - Mattırlar.
- Kırılgan katı olma eğilimi nedeniyle, dövülüp şekil verilemez, tel ve levha hâline getirilemezler.
- Canlı yapısında bol miktarda bulunurlar.
- Kendi aralarındaki kimyasal tepkimelerde elektronlarını ortaklaşa kullanırlar.
- Metallerle olan kimyasal tepkimelerde metallerden elektron alarak (-) yüklü iyon oluştururlar.
Yarı Metaller
- Özel koşullar altında elektrik iletirler.
- Metalik bir parlaklığa sahip olabilirler.
- Değişken yoğunluk, sertlik, iletkenlik özelliklerine sahiptirler.
- Kırılgan değildirler. Tel ve levha hâline gelebilirler.
- Kimyasal tepkimelerde metallerden elektron koparırlar, ametallerle ve kendi aralarında elektronlarını ortaklaşa kullanırlar.
Soy gazlar
- Uçan balonlarda ve dalgıç tüplerinde Helyum (He), parlak neon lambalarında neon (Ne), floresan lambalarında argon (Ar) gazı kullanılır.
Periyodik Özelliklerin Değişimi

Elementler periyodik sistemde benzer özelliklerine göre sınıflandırıldığından, bazı özellikler periyodik olarak (düzenli ve belirli aralıklarla) periyok ya da grup boyunca tekrar eder. Bu özellikler;
- Atom yarıçapı,
- İyonlaşma enerjisi,
- Elektron ilgisi,
- Elektronegatiflik,
- Metalik ve ametalik karakterdir.
İyonlaşma Enerjisi (İE)

Gaz haldeki bir elementin tek bir atomundan (ya da iyondan) bir eleketronu uzaklaştırmak için atoma verilmesi gereken en düşük enerjidir ve “İE” ile gösterilir. Gaz haldeki bir elementin atomundan (nötr atom) bir elektron koparmak için gerekli olan enerji birinci iyonlaşma enerjisi (İE1), bir elektronu kopmuş atomdan bir elektron daha koparmak için gerekli olan enerji ikinci iyonlaşma enerjisidir (İE2).
Eğer bir atoma yeterli miktarda enerji verilirse atomdan sahip olduğu elektronların tamamı koparılabilir. Her atomun elektron sayısı kadar iyonlaşma enerjisi vardır.
Atom Yarıçapı

Atom yarıçapı, bir atomun boyutunun ölçüsüdür, çekirdekten en dış katmanda yer alan elektrona kadar olan uzaklıktır. Periyodik sistemde soldan sağa doğru periyot boyunca gidildikçe atom yarıçapı azalır. Bunun sebebi aynı periyotta yer alan element atomlarının katman sayısı değişmezken çekirdekteki proton sayısı artar. Bu artış çekirdeğin çekim gücünü de artırır ve son katmandaki elektronların daha güçlü çekilmesine, elektronların çekirdeğe yaklaşmasına neden olur. Böylece atomların çapı soldan sağa doğru azalır, dolayısıyla atom yarıçapı büyür.
Elektron İlgisi

Gaz haldeki bir element atomunun yapısına bir elektron katıldığında atomda meydana gelen enerji değişimi yani atomun elektron alma/verme isteğidir.
Elektron ilgisi periyot boyunca soldan sağa doğru genellikle artar, aynı grupta ise yukarıdan aşağıya inildikçe genellikle azalır. Soygazların elektron ilgisi neredeyse sıfırdır. Ametallerin elektron alma isteği metallerden oldukça fazladır ve bu nedenle ametallerin elektron ilgisi metallerinkinden büyüktür.
Elektronegatiflik

Kimyasal bağ oluşumunda kullanılan son katman elektronlarının bağı oluşturan atomlar tarafından çekilme gücüdür. Elektronegatiflik, bir atomun bağ oluşturma olasılığının ne kadar yüksek olduğunu gösterir.
Elektronegatiflik aynı periyotta soldan sağa gidildikçe artar ve aynı grupta aşağı inildikçe azalır. Soygazlarda ise elektronegatiflik sıfıra yakındır. Elektronegatiflik değerleri arasındaki fark ne kadar büyük olursa iki atomun kimyasal bir bağ oluşturması o kadar muhtemeldir.
Metalik-Ametalik Karakter
Kimyasal tepkime esnasında elektron verme eğilimi olan elementler metalik, elektron alma eğiliminde olan elementler ise ametalik karakter gösterir. Aynı grupta yer alan elementlerin metalik özelliği aşağı inildikçe artar. Aynı periyotta ise soldan sağa gidildikçe metalik özellik azalır.
Ayrıca bakın;
Dış bağlantılar ve kaynak;
- Dmitri Mendeleyev – Vikipedi (wikipedia.org)
- https://acikders.ankara.edu.tr/pluginfile.php/14462/mod_resource/content/0/8.%2C 9. ve 10. Hafta Bölüm 4 Periyodik Sistem.pdf
