
Atom kelimesi Yunanca bir kelimeden “atomos” türetilmiştir ve “bölünemez” anlamına gelir. Çünkü varlığı keşfedildiğinde evrendeki en küçük şey olduğu ve asla bölünemeyeceği düşünülmüş, fakat daha sonra yapılan çalışmalar atomun daha da küçük (atom altı) parçacıklardan oluştuğunu göstermiştir. Bazı olağandışı durumlarda atomun parçalandığı ortaya çıkmıştır. Bu sözcüğü ilk kullan kişi ise Demokritostur.
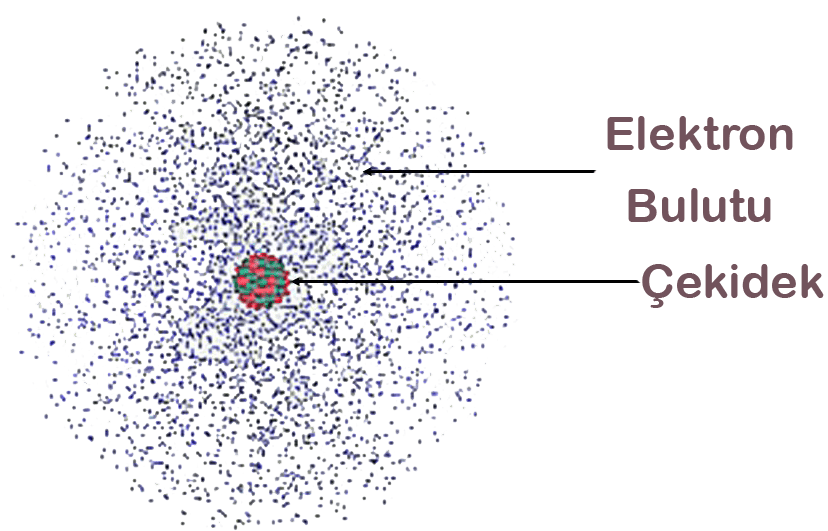
Atom, çıplak göz ile görülmesi imkânsız, çok küçük bir parçacıktır ve sadece atomik kuvvet mikroskobu ile görüntülenip, incelenebilir. Bir atom, çekirdeği saran negatif yüklü bir elektron bulutu, çekirdek içerisinde pozitif yüklü protonlar ve nötronlardan (yüksüz) oluşur. Proton sayısı elektron sayısı ile eşit olduğunda atom elektriksel olarak nötr yani yüksüzdür.
Atom Teorisinin Tarihi
Bugün 13,5 milyar ışık yılı çapında olduğunu düşündüğümüz evrenin bir parçası olan Güneş Sistemi bizim için oldukça büyük, elementleri oluşturan ve yaşamamıza olanak sağlayan atomlar ise bir o kadar küçüktür. Karmaşık ve çok büyük ya da çok küçük olan şeyleri incelemek ve anlamak oldukça zordur. Bu nedenle bu şeyleri kavramak isteyen bilim insanları yaptıkları çalışmalarda edindikleri bilgi ve deneyimlerini kolay anlatmak için modeller kullanırlar.
Modeller gerçek olanın anlaşılabilir bir temsilidir. Gerçek olanla aynı boyutta olabileceği gibi (tabii ki tutarlılık ölçüsünde) farklı boyutlarda da olabilir. Örnek olarak; Üzerinde yaşayarak yaşamımızı sürdürdüğümüz Dünyanın bir modeli kendisinden çok daha küçüktür. Atom modelleri ise tam tersine, gerçek atomdan çok daha büyüktür. Modeller bilimdeki gelişmeler ışığında değiştirilebilir ya da tamamen yeni bir model oluşturulabilir. Modern kimya dönemi olarak adlandırdığımız dönemde atomlar hakkında birçok keşif yapılmıştır. Bu keşifleri anlatabilmek ve atomun yapısını ifade etmek için birçok atom modeli geliştirilmiştir.
Maddeleri oluşturan temel parçacıkların ne olduğu ya da maddenin nereye kadar parçalanabileceği eski çağlardan günümüze kadar yaşayan insanlar tarafından merak edilmiş, sorgulanmış ve araştırılmıştır. Yapılan bu sorgulama ve araştırmaların sonucu olarak da birçok fikir ortaya atılmış, teknoloji ilerledikçe de deney yapabilme, deney sonuçlarını daha net bir şekilde alma ve bilgisayar ortamında modelleme ilerlemiş, bu fikirlerin yanlışlıkları elenerek günümüz atom teorisi oluşturulmuştur.
Farklı Atom Modelleri
Yukarıda modelin tanımını yaptık gelin geçmişte ileri sürülen farklı atom modellerini inceleyelim.
Dalton Atom Modeli
19. yüzyılın başlarında John Dalton, maddenin her halinin (katı, sıvı ve gaz) küçük parçacıklardan oluştuğunu öne sürmüştür. Dalton’a göre;
- Atomlar içi dolu berk küreciklerdir.
- Her element, atom adı verilen son derece küçük parçacıklardan oluşur.
- Yok edilemez, yoktan var edilemez ya da bölünemez.
- Aynı elementin tüm atomları özdeştir.
- Madde, aynı ya da farklı türdeki atomların bir araya gelmesiyle oluşur.
- Farklı element atomları farklı özelliklere sahiptir. Örneğin; kütleleri ve verdiği kimyasal tepkimeler farklıdır.
- Bir elementin atomları, kimyasal tepkimeler ile farklı atom türlerine dönüşemez.
Thomson Atom Modeli

Joseph John Thomson, 1897 yılında “crookes tüpü” (bir gaz boşaltma tüpü) ile yaptığı çalışmalarda atomun yapısından yüklü parçacıkların ayrıldığını keşfetti. Bu parçacıkların negatif (-) yüklü ve her tür atomu oluşturan ortak parçalardan biri olduğu sonucuna vardı. Bu negatif yüklü parçacıklara elektron adını verdi. Ona göre, elektronlar ato terk edip tüpün içerisinde hareket edebiliyorsa atomun bölünemez olduğu düşüncesi de yanlıştı.
Yine Thomson’a göre atomun kütlesine göre çok küçük kütleye sahip eksi yüklü elektronlar varsa, atomda elektronlar dışında kalan kütle pozitif yüklü olmalıydı. Böylece Thomson’ un “Üzümlü Kek Modeli” olarak adlandırılan atom modeli oluştu.
Dalton’un atom modelinde belirttiği gibi atomun içi dolu ve bölünemez küreler olmadığını kanıtlamıştır.
Thomson atom modeline göre;
- Atom, artı yüklü madde içine gömülü elektronlardan oluşmaktadır.
- Elektronlar hareket etmezler ve artı yüklü madde içinde homojen olarak dağılmışlardır.
- Elektronların kütleleri çok küçüktür bu yüzden atomun kütlesini artı yüklü madde oluşturur.
- Atom küre şeklindedir.
Rutherford Atom Modeli

Rutherford, 20. yy başlarında, Thomson’ın üzümlü kek modelini test etmek için bir deney tasarladı ve yaptığı deneyler sonucunda;
- Atomun yapısında büyük boşluklar bulunduğunu, pozitif yükün belirli bir bölgede (merkezde) toplanmış olduğunu sonucuna ulaştı. Keşfettiği bu pozitif yüklü merkeze ise çekirdek adını verdi.
- Pozitif yüklü tanecikler kadar elektron bulunduğunu ve bu elektronların çekirdek etrafındaki büyük boşluklarda sürekli hareket halinde olduğunu söylemiştir.
Ayrıca atom kütlesinin yaklaşık yarısını oluşturan başka bir taneciğin (nötronun) olabileceğini öngörmüş ancak bu tanecik daha sonraki yıllarda James Chadwick tarafından keşfedilmiştir (1982).
Bohr Atom Modeli

Rutherford, atom modelinde, atomun yapısını ve atomu oluşturan parçacıkların konumunu belirtmiş ancak elektronların çekirdek etrafındaki davranışlarını açıklayamamıştır. Niels Bohr, oluşturdupu atom modelinde ışın ve atomlar arasında bağlantı kurmaya çalışmış ve 1913 yılında geliştirdiği atom modelinde elektronların davranışını açıklamıştır.
Bu atom modelini bütün elementlerin en basiti olan hidrojen element atomu için geliştirmiştir. Model, proton ve nötronları içeren çekirdek ile çelkirdeğe belirli uzaklıklardaki dairesel yörüngelerde hareket eden elektronları içermektedir.
Modern Atom Teorisi
Niels Bohr’un oluşturduğu atom modeli elektronların belirli enerji seviyelerinde bulunduğunu belirteler atomun yapısıyla ilgili araştırmalara önemli bir katkı sağlamıştır. Bir elektronun üst enerji seviyelerine çıkarken ne kadar enerji aldığını ve alt eneri seviyelerine inerken de ortama ne kadar enerji yaygığını hesaplamıştır. Ancak bunu sadece tek elektronlu taneciklere (1H, 2 He 1+, 3 Li 2+vb.) uygulayabilmiş, çok elektronlu atomların yaydığı veya soğurduğu enerjiye açıklık getirememiştir.
Daha sonra 1925 yılından itibaren Heisenberg, Schrödinger ve diğer bilim insanlarının da katkılarıyla, atomun yapısı ve elektronların davranışını açıklayan ve günümüzde genel olarak kabul gören modern atom teorisi geliştirilmiştir.
Teori; var olan bilimsel bir olgunun, gözlemin neden ve nasıl olduğunun bilimsel veriler ve deney sonuçlarına dayanarak açıklamasıdır. Modern atom teorisinde elektronların davranışı elektron bulutu modeli ile açıklanmaktadır. Bu model, bohr atom modelinden farklı olarak elektronların çekirdeğin çevresindeki belirli yörüngelerde değil, belirli enerji seviyelerindeki belirli bölgelerde bulunma ihtimali olduğunu ileri sürmektedir
Yapısı
Atomun yapısını oluşturan elektron, proton ve nötronun bilinir olmasıyla, elementlerin farklı davranışlarının nedeni de anlaşılmıştır. Bunun nedeni farklı element atomlarının sahip olduğu proton, nötron ve elektron sayılarının farklı olmasıdır.
Çekirdek, atomun pozitif yük merkezidir ve kendisini oluşturan proton ve nötronlar, çok güçlü kuvvetler ile bir arada durur. Çekirdeğin pozitif elektrik yükünü (çekirdek yükü), protonlar oluştururken, nötronların net bir elektrik yük yoktur. Elektronlar, atomun kütlesine oranla çok küçük bir kütleye sahiptir. Atomun neredeyse tüm kütlesini çekirdek oluşturur. Bu nedenle atomun kütlesi hesaplanırken çekirdeği oluşturan proton ve nötronlar dikkate alınır. Proton ve nötronun kütlesi birbirine çok yakındır. Atomun çekirdeği ise atomun genel çapından çok küçüktür. Çünkü elektronlar atom çekirdeğinden oldukça uzakta bulunur.
Elektronlar atom kütlesine belirgin bir katkısı olmamasına rağmen tüm kimyasal tepkimelerde başrol oynar. Proton (+1) ve elektronun (-1) ikisi de elektrik yüklüdür. Protonun elektronun yükü büyüklük açısından eşit ancak ters işaretlidir. Bu durumda, eşit sayıda proton ve nötrona sahip olan atomlardaki toplam yük miktarı sıfırdır olur, yani atom nötrdür. Aşağıdaki tablo da atomu oluşturan parçacıkların kütlesi ve diğer özellikleri yer almaktadır:

Nükleon

Atomun çekirdeğinde bulunan proton (+ yüklü) ve nötronlar (yüksüz) birlikte nükleon olarak adlandırılır. Her atomun çekirdeği içerisinde en az bir adet proton bulunur, nötron ise çekirdeğinde birden fazla proton bulunan atomlarda yer alır. Çekirdekteki proton sayısı aynı zamanda atom numarasıdır. (Hidrojen atomunun yapısında 1 adet proton bulunur ve atom numarası 1’dir.) Çekirdekteki nötron ve proton sayılarının toplamı da maddenin atom ağırlığıdır.
Elektron (-)
19. yüzyılın sonlarına doğru elektrikle yapılan deneyler sonucunda uzunca bir süre maddenin en küçük yapıtaşı olarak kabul edilen atomdan da küçük taneciklerden oluştuğu düşünülmeye başlandı. 1874’de Faraday’ın çalışmalarını göz önüne alarak George Johnstone Stoney, atomlarda elektrik yüklü birimlerin bulunduğunu söyledi ve 1891 de bu birimlere elektron adı verilmesini önerdi. Vakumdan elektrik akımının geçirildiği deneyler, 1859’da Julius Plucker’in katot ışınlarını bulmasına yol açtı. Bilim adamlarının gerçekleştirdiği deneyler ile katot ışınlarının hızla hareket eden eksi yüklü parçacık oldukları sonucuna varıldı ve bu parçacıklara elektronadı verildi.
Enerji ve elektron yörüngeleri

Enerji, iş yapmaya yarayan güçtür, yani her iş belirli bir enerji ile gerçekleşir. Enerjinin Sakınımı Yasasına göre; enerji yoktan var, vardan da yok edilemez ancak bir enerji türü başka bir enerji türüne çevrilebilir. Örneğin; Güneş enerjisi, elektrik enerjisine dönüştürülebilir.
Atom yörüngeleri yandaki gibi çekirdeğin etrafında dönen elektronlardan oluşur ve her yörünge farklı enerji düzeylerine sahiptir. İlk yörüngede en fazla iki adet elektron bulunabilir ve bir atomdaki toplam elektron sayısı ise 2n² formülü ile hesaplanır (bu formülde n toplam yörünge sayısıdır.)
Elektronların herhangi bir nedenle kazanacağı ilave enerji, bu elektronların kendi enerji düzeylerine uygun başka bir yörüngeye sıçramasına yol açar ve bu şekilde bir yörüngeden başka bir yörüngeye geçişleri sırasında elektromanyetik dalga türü radyasyon salınır. Dışarıya salınan radyasyonun enerjisi, elektronların geçtiği yörüngeler arasındaki enerji farkına eşittir.

Değerlik elektron
Atomda serbest elektronlar çekirdekten uzaklaştıkça çekirdeğe bağlanma güçleri zayıflar. Bu sebeple çekirdeğe en zayıf bağlarla bağlanan elektronlar, atomun dış yörüngesinde bulunur. Dış yörüngedeki zayıf bağlı elektronları koparmak kolay olduğundan değişik kimyasal olarlarda bu elektronlar rol oynar.
Serbest elektronlar, atomun dış yörüngesinde ya da atomlar arası boşluklarda dolaşan, uyarıldıklarında yörüngesini terk ederek başka bir atamon yörüngesine geçebilen elektronlardır. Atom veya moleküllerin bu şekilde elektron kazanması ya da kaybetmesi olayına iyonizasyon denir. Elektron kaybeden veya kazanan atomlara ise yüklü atom ya da iyon adı verilir. İyon halindeki atomlar + veya – yüklendiklerinden, diğer yüklü cisimler ile karşılaştıklarında Coulomb Yasası uyarınca itilir veya çekilir.
Serbest elektronlardan başka yüksek enerjili radyasyonlar da iyonizasyona yol açar; Gama ve x ışınları gibi yüksek enerjili radyasyonlar havadan geçerken havayı iyonlaştırır.
Ayrıca bakın;
Dış Bağlantılar;
